敗血症は、体のどこかにできた感染に対して、からだの反応が暴走し、臓器がうまく働かなくなる状態です。命に関わります。
敗血症の最新の定義(Sepsis-3)では「感染による宿主応答の破綻で生じる生命を脅かす臓器障害」とされています。
原因の多くは細菌による肺炎・尿路感染・腹部感染・傷や点滴部位の感染などです。ウイルス(例:インフルエンザ、COVID-19)や真菌でも起こります。「血が汚れた」わけではなく、“感染への過剰反応”で臓器が傷むのがポイントです。
目次
敗血症とは(Sepsis-3の要点)
2016年2月に敗血症の新たな定義(Sepsis-3)と診断基準を発表しました。
参考文献:The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)
1991年のSepsis-1、2001年のSepsis-2に続く、2016年に発表された敗血症の新たな定義のことです。
この中で敗血症は、従来の定義である、感染に起因するSIRS(Sepsis-1)、および感染による全身症状を伴った症候(Sepsis-2)に代わって、「感染に対する生体反応が調節不能となることにより、重篤な臓器障害が引き起こされた状態(Sepsis-3)と定義されました。
定義:感染+臓器障害(SOFA+2以上)
敗血症は「感染によって重篤な臓器障害が引き起こされる状態」と定義されます。
臨床では、SOFAがベースラインから+2以上を臓器障害として扱います(ベースライン不明は0とみなします)。
菌血症との違い(血液培養陽性=敗血症ではない)
菌血症=「血流に病原体が存在」、敗血症=「感染に伴い臓器障害を呈する臨床症候群」です。
したがって、血培陽性でも臓器障害がなければ“敗血症”ではありません。逆に血培陰性でも臓器障害を伴えば敗血症は成立し得ます。検査解釈と初期対応を誤らないために、まずこの切り分けを明確にします。
敗血症性ショックの位置づけと予後
敗血症性ショックは敗血症のサブセットで、十分な輸液後MAP≥65 mmHgの維持に昇圧薬を要し、乳酸>2 mmol/L(18 mg/dL)を示す病態として臨床的に特定されます。
非ショックに比べ死亡リスクは明らかに高く、初期1時間での抗菌薬投与・輸液・昇圧の到達が転帰に直結します。
どんな患者に多いか(高齢・免疫抑制・慢性疾患)
高齢者、免疫抑制(ステロイド・免疫抑制薬・化学療法)、慢性疾患(糖尿病、慢性腎不全〈特に維持透析〉、悪性腫瘍など)ではリスクが高いです。
特にESKDで透析中の患者は血流感染のリスクが高く、敗血症につながりやすい点に注意します。
敗血症の診断の流れ
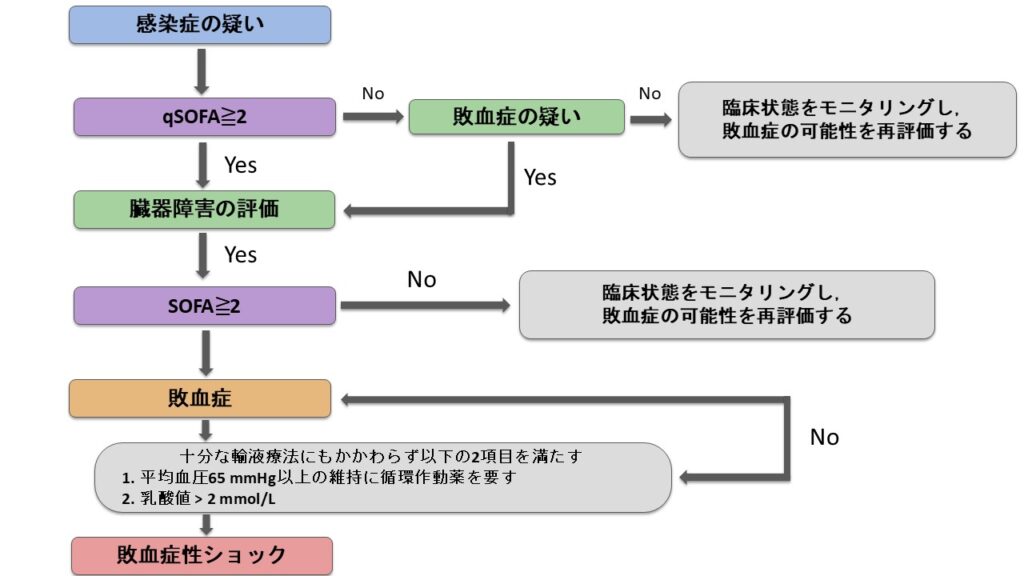
Sepsis-3では、上の図のフローチャートに沿って敗血症を診断することを推奨しています。
流れとしては以下のとおりです。
- 感染が疑われる患者のベッドサイドでqSOFAを評価。
(GCS<15、呼吸数≧22回/分、収縮期血圧≦100mmHgのうち2項目満たした場合は敗血症疑いとなります) - 次にSOFAスコアを評価。
(SOFAスコア2点以上の上昇が認められた場合は敗血症の診断となります)
SOFAスコア
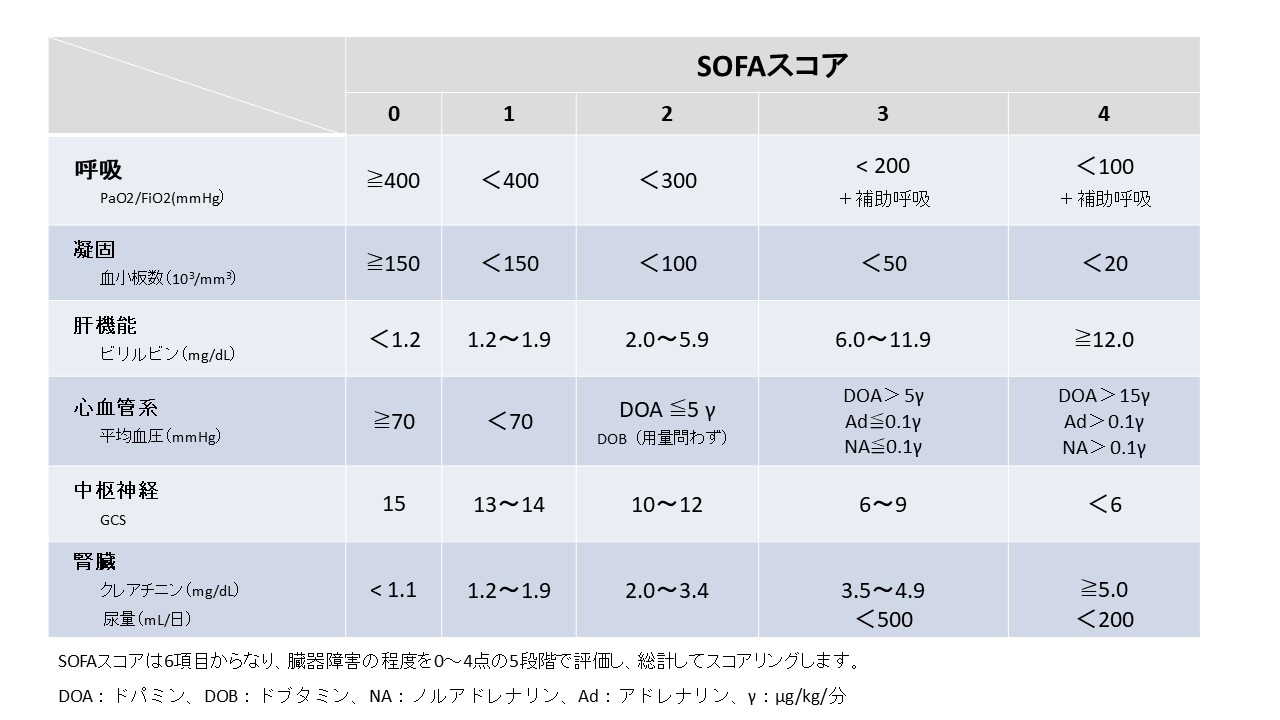
SOFAは呼吸・凝固・肝・循環・中枢神経・腎の6領域を、それぞれ0~4点で採点し、総計してスコアリングします。
SOFAスコアの目的
SOFAは、呼吸・凝固・肝・循環・中枢神経・腎の6領域を、0(ほぼ正常)→4(きわめて重い障害)の5段階で評価します。
臓器ごとに指標は違いますが、“重さ”の意味合いは共通です。
すなわち、SOFAの目的は全身の臓器障害を数値化し、その重症度と変化を客観的に把握するためのものです。
qSOFAの見方(現場でのスクリーニング)
3項目と判定基準(RR≥22/収縮期≤100/意識障害)

qSOFAは呼吸数、収縮期血圧、意識状態の3項目あり、このうち2項目を満たす場合を陽性とします。
「2点以上」の意味と次の一手(採血・SOFA評価へ)
qSOFAが陽性なら重症化リスクが高いです。直ちに採血(乳酸、血液培養2セット、腎肝機能、凝固機能)を行い、SOFAスコアで臓器障害をスコアリングし、感染源評価と初期治療(広域抗菌薬、輸液、必要時昇圧)をおこないます。
参考文献:A:日本集中治療医学会/日本救急医学会. 日本版敗血症診療ガイドライン2024(J-SSCG 2024)本編・付録. 2024.(オンライン公開)
使う場面:院外・外来・病棟での利点
qSOFAはICU外での迅速な“危険サイン”検出が目的で、バイタルのみで判定可能なのが利点です。
限界と誤判定しやすいケース(高齢者・β遮断薬内服など)
qSOFAは感度が低く、陰性でも敗血症を除外できません。
ガイドラインは単独のスクリーニングとしての使用を推奨していません。高齢者ではバイタル変化が目立ちにくい、基礎の認知症でGCSが低い、β遮断薬などで生理反応が鈍化する――といった理由で偽陰性/偽陽性が起きやすいので注意が必要です。
“最初の1時間”でやること
タイムライン管理(T0→T60分:チェックリスト)
Time 0分(診断を疑った時点):タイマー起動/気道・呼吸・循環の一次評価、SpO2・血圧・心拍・体温を即確認。
Time 10分:静脈路確保(必要なら2本)、乳酸測定、血液培養2セット採取(可能な限り抗菌薬投与前)、腎肝機能・凝固・血糖など採血。
Time 30分:ショックまたは高乳酸(例:≥4 mmol/L)なら晶質液ボーラス(目安 30 mL/kg)を開始。
Time 45分:感染源を想定した広域抗菌薬の初回投与(培養採取を待てずに遅れる場合は投与を優先)。
Time 60分:MAPが65 mmHg未満ならノルアドレナリン開始(目標MAP≥65 mmHg)。画像・ドレナージなどソースコントロールの段取りを固める。乳酸が初回高値なら再測定のタイミングを指示。
乳酸測定と再測定の指針
乳酸は組織低灌流の指標です。
初期評価で必ず測定し、初回高値なら再測定(目安 2–4時間内)でトレンドをフォローします。
参考文献:A:Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign 2021(乳酸測定・再測定の推奨).
抗菌薬:培養採取→できるだけ早く初回投与
血液培養は抗菌薬投与前に2セットが原則です。
敗血症性ショックでは原則1時間以内の広域抗菌薬投与を目標にします。腎機能に応じた初回投与量の減量は避けます。
培養結果・臨床経過でデエスカレーションします。
参考文献:A:Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign 2021(培養前採取と早期抗菌薬).
輸液:30 mL/kg晶質液の適応と例外
適応:ショック、または乳酸高値(例:≥4 mmol/L)を伴う低灌流が疑われる場合に、晶質液30 mL/kgで投与します。
初期評価と感染源アセスメント
肺・尿路・腹腔・皮膚/デバイスの起点別チェック
肺:新規の浸潤影/呼吸需要↑/喀痰性状の変化。人工呼吸器管理では下気道検体(非侵襲的な気管吸引)を抗菌薬投与前に採取し、施設のアンチバイオグラムを反映して起点菌を想定します。
尿路:発熱+排尿症状/CVA叩打痛/高齢者のせん妄。閉塞の有無を早期に評価(エコー/CT)。閉塞・膿瘍・異物(カテーテル/結石)があれば除去・ドレナージを優先。
腹腔:腹痛/反跳痛/胆道系所見。造影CTで膿瘍・穿孔・閉塞の有無を確認し、必要時は胆道ドレナージ/膿瘍穿刺を準備。
皮膚/デバイス:壊死・腫脹・ガス像を見逃さない。中心静脈カテーテルはS. aureus/真菌/不安定なら抜去を基本に、培養2セットと先端培養を手配。
参考文献:
A:Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the IDSA and ATS. Clin Infect Dis. 2016;63(5):e61–e111. doi:10.1093/cid/ciw353. /
A:European Association of Urology. EAU Guidelines on Urological Infections 2024. Section 3.9.5.2.2 Source control(尿路閉塞は至急ドレナージ). /
A:Mermel LA, Allon M, Bouza E, et al. Clinical Practice Guidelines for the Diagnosis and Management of Intravascular Catheter-Related Infection: 2009 Update by IDSA. Clin Infect Dis. 2009;49(1):1–45. doi:10.1086/599376.
画像・穿刺・ドレナージの優先順位(ソースコントロール)
ソースコントロールは早期(目安6–12時間以内)が原則。具体的には、膿瘍ドレナージ、壊死組織デブリードマン、閉塞解除(胆道・尿路)、感染デバイスの除去。全身管理(気道・循環)と並行して、画像で「抜く/開ける/外す」対象を確定し、実行までの段取りを先に決めます(場所・術者・同意・血液製剤)。尿路閉塞や胆道感染はドレナージが救命手段になるため最優先。
参考文献:
A:Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021. Intensive Care Med. 2021;47:1181–1247. doi:10.1007/s00134-021-06506-y(ソースコントロールは可及的速やかに、概ね6–12時間). /
A:EAU Guidelines 2024. Urosepsisのソースコントロール(尿路閉塞・膿瘍・異物の除去は最重要、緊急対応). /
A:De Waele JJ, et al. Importance of timely and adequate source control in sepsis. Crit Care. 2024;28:127(12時間以内の介入を推奨する根拠を総説).
院外/院内発症での起因菌想定と抗菌薬選択の違い
院外発症:肺炎なら肺炎球菌やEnterobacteralesが中心。尿路はE. coliが最多。腹腔は嫌気性菌+腸内グラム陰性の混合。まずは起点+重症度+地域の耐性率で選択し、培養で速やかにデエスカレーション。
院内発症(HAP/VAP・術後・長期留置デバイス):MRSA、Pseudomonas、Acinetobacter、ESBL/CREなどMDRを想定。MRSAカバー(バンコマイシン/リネゾリド)や、MDRリスクが高い場合は二剤の抗緑膿菌カバーを検討。近年はESBL/CRE、DTR-P. aeruginosaへの対応が重要で、セフタジジム/アビバクタム等の新規βラクタマーゼ阻害薬併用剤の位置づけを最新ガイダンスで確認します。最終的には施設アンチバイオグラムと患者の直近の抗菌薬曝露で調整。
参考文献:
A:Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With HAP/VAP: 2016 IDSA/ATS Guideline. Clin Infect Dis. 2016;63(5):e61–e111. doi:10.1093/cid/ciw353(MRSA/緑膿菌カバーと二剤併用の適応). /
A:Tamma PD, Aitken SL, Bonomo RA, et al. IDSA 2024 Guidance on Treatment of Antimicrobial-Resistant Gram-Negative Infections, Ver.4.0. Clin Infect Dis. 2024;ciae403. doi:10.1093/cid/ciae403(ESBL/CRE/DTR-Pseudomonas/CRAB/SM対応).
検査の押さえどころ
乳酸の読み方(持続高値・クリアランス)
乳酸は組織低灌流の間接指標。初回高値(例:≥4 mmol/L)は重症化リスクを示唆し、2–4時間内の再測定でトレンドを追います。
治療に反応して乳酸クリアランス(初回値からの%低下)が得られれば予後良好のサイン。一方で、β刺激薬投与、痙攣、肝障害などでも高値化し得るため、単独での意思決定は避け、MAP・尿量・皮膚所見・ダイナミック指標と併読します。
PCT/CRPの使い分けと限界
PCT(プロカルシトニン)は細菌感染の活動性評価や抗菌薬中止の意思決定補助に有用ですが、腎不全・重症外傷・術後では偽高値。開始判断の単独根拠にはしないのが基本です。
CRPは感度が高い一方で非特異的で立ち上がりが遅く、経時変化でのトレンド把握が実務的です。両者とも臨床像・培養・画像と統合して使う前提です。
血液培養:2セットの原則とタイミング
原則は「2セット以上」「投与前」「十分量」。成人は1セット20–30 mLを別部位から2セット以上採取します(コンタミ低減と感度向上)。
中心ライン感染が疑わしければ経皮採血+ライン採血の比較を行い、抗菌薬投与は遅らせない方針で並行します。発熱ピークや悪寒戦慄時にこだわりすぎず、早期採取を優先します。
参考文献:A:Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign 2021(培養は抗菌薬前に2セット、十分量).
迅速検査(尿・便・抗原・PCR)の使い所
尿中抗原:重症市中肺炎で肺炎球菌・レジオネラを迅速同定し、早期デエスカレーションに寄与。
呼吸器PCR:インフルエンザ/RSV/SARS-CoV-2等を検出し、抗菌薬短縮と隔離対策に有用。
便PCR/トキシン:重症・血性下痢やアウトブレイク疑いで多病原体PCR。C. difficileはトキシン+NAATアルゴリズムを推奨。
尿検査:ニトリット・白血球エステラーゼはスクリーニング。閉塞徴候があればエコー/CTで早期に閉塞除去まで計画。
初期治療の実践(合併症に配慮)
体液管理:心不全・AS・CKD/HD患者での調整
初期は晶質液で迅速に蘇生しつつも、心不全・重症大動脈弁狭窄(AS)・CKD/HDでは過負荷のリスクが高いため、250–500 mL刻みで反応性(受動的下肢挙上、エコー、ストロークボリューム変化)を見て調整します。
原則:①平衡(バランス型)晶質液を優先、②反応が乏しければ輸液より昇圧を先行、③大量が必要ならアルブミン追加を検討、④ASやうっ血傾向では早期から肺うっ血・右心負荷の所見を並行評価。HD患者は初回のローディングは減らし過ぎないが、その後は浮腫・肺うっ血を避けつつ、必要に応じて腎代替療法で体液是正を図ります。
昇圧薬の立ち上げと併用(バソプレシン等の位置づけ)
第一選択はノルアドレナリン。MAPが65 mmHgに届かない/高用量を要する場合は、バソプレシン(例:0.03 U/分)追加でノルアドレナリン用量を節約します。反応不十分ならエピネフリン追加を検討。ドパミンは不整脈リスクから原則回避。慢性高血圧では個別にやや高めのMAPを検討するが、初期目標は65 mmHgを基本とします。
参考文献:A:Surviving Sepsis Campaign Adult Guidelines 2021(ノルアドレナリン第一選択、バソプレシン追加、MAP目標65).
抗菌薬のデエスカレーション戦略と投与量調整
初回は起点+重症度をカバーする広域で開始し、48–72時間で培養・感受性・臨床経過に基づき狭域化(デエスカレーション)。臓器障害下でも初回ローディングは減らさないのが原則で、その後は腎/肝機能で維持量を調整。βラクタムはPK/PD最適化(延長/持続投与を含む)を検討し、バンコマイシンはAUC/MIC 400–600を目標にTDMを行います。PCTや臨床安定で早期中止を含む期間短縮も検討します。
参考文献:A:Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign 2021(デエスカレーション・投与期間・PK/PD). / A:Rybak MJ, Le J, Lodise TP, et al. Therapeutic monitoring of vancomycin for serious MRSA infections: 2020 consensus. Am J Health-Syst Pharm. 2020;77(11):835–864(AUC 400–600).
発熱コントロール・鎮静/鎮痛・グルココルチコイドの考え方
発熱:アセトアミノフェンは快適性のために使用可だが、主要アウトカム改善は示されていません(HEAT試験)。
鎮痛/鎮静:Analgesia-Firstでオピオイド最小有効量、鎮静は最小限・覚醒志向(プロポフォール/デクスメデトミジン中心)。せん妄対策・睡眠/可動化も同時に。
グルココルチコイド:昇圧薬依存性の敗血症性ショックではヒドロコルチゾン 200 mg/日を考慮(持続/分割)。高血糖・二次感染に注意してモニタリングします。
参考文献:A:Young P, et al. Acetaminophen for Fever in Critically Ill Patients with Suspected Infection(HEAT). NEJM. 2015;373:2215–2224(主要転帰差なし). / A:Devlin JW, Skrobik Y, Gélinas C, et al. PADIS 2018(鎮痛・鎮静・せん妄・睡眠・可動化). / A:Lewis K, Balas MC, Stollings JL, et al. PADIS フォーカスアップデート 2025. / A:Surviving Sepsis Campaign 2021(副腎皮質ステロイドの位置づけ).
よくある誤解と落とし穴
qSOFA陰性=安心ではない
qSOFAは「重症化の合図」を拾う簡便指標であり、陰性でも敗血症を除外できません。スクリーニングはNEWS/MEWS等や臨床所見と併用し、陰性でも「呼吸数増加・意識変容・尿量低下」などの臓器障害サインがあれば採血とSOFA評価へ進みます。
血圧が保たれていても臓器障害が進む
MAPが一時的に保たれていても、腎機能悪化・意識低下・低PaO2/FiO2など臓器障害の進行は起こり得ます。敗血症は「感染+臓器障害」で定義されるため、MAPだけを追わず、末梢灌流やSOFAの連続評価で重症化を捉えます。
参考文献:A:Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801–810. doi:10.1001/jama.2016.0287. / A:Hernández G, et al. ANDROMEDA-SHOCK:末梢灌流指標を目標とした蘇生戦略の効果. JAMA. 2019;321(7):654–664. doi:10.1001/jama.2019.0071.
乳酸正常でも重症はあり得る
乳酸は重要な補助指標ですが、正常でも重症例は存在します。
「乳酸だけ」を目標にせず、臓器障害・末梢灌流・尿量・ガス交換などを総合評価し、必要なら再測定でトレンドを追います。
参考文献:A:Sauer CM, et al. Understanding critically ill sepsis patients with normal lactate levels. Sci Rep. 2021;11:20420. doi:10.1038/s41598-021-99581-6. / A:Evans L, et al. Surviving Sepsis Campaign 2021(乳酸は再測定を含む補助指標、単独での意思決定は不可).
培養陰性=感染否定ではない
敗血症の20–40%前後は培養陰性とされ、採取前抗菌薬や局在感染、技術的要因で陰性化します。
臓器障害を伴う臨床像があれば培養陰性でも敗血症は成立し、起点・重症度にもとづき治療を継続、結果に応じてデエスカレーションします。
参考文献:A:Phua J, et al. Characteristics and outcomes of culture-negative versus culture-positive severe sepsis. Crit Care. 2013;17:R202. doi:10.1186/cc12896. / A:Kim J, et al. Characteristics and clinical outcomes of culture-negative septic shock. Acute Crit Care. 2021;36(1):14–22. doi:10.4266/acc.2020.00024.