オンラインHDFとは
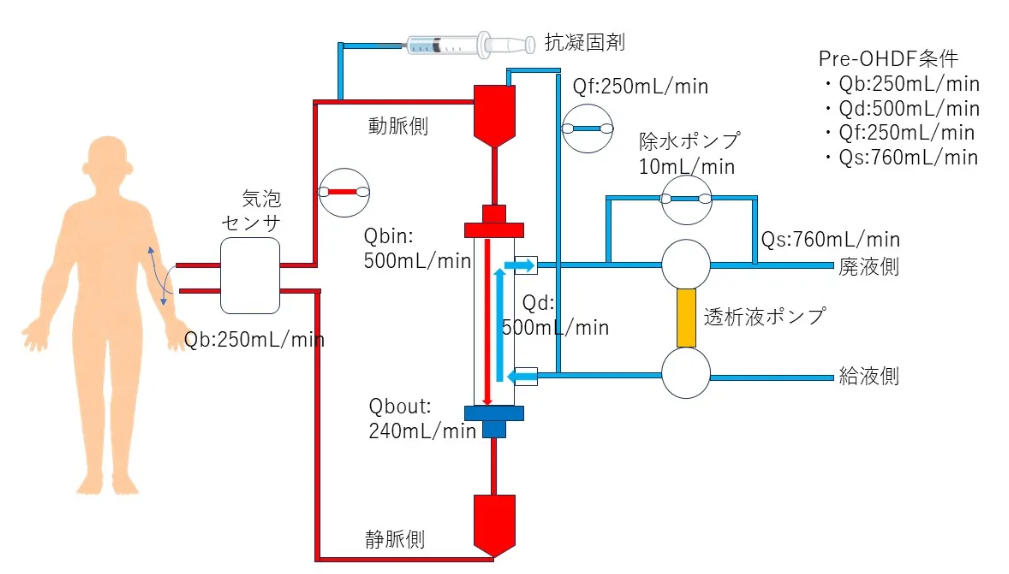
オンラインHDF(online hemodiafiltration)は、拡散(HD)と濾過(HF)を組み合わせて、中〜大分子や蛋白結合毒素の除去を高めるモダリティです。
- 目的:小分子だけでなく中〜大分子(例:β2-MG、α1-MG)を狙い、症状と長期転帰の改善をめざす。
- 条件の肝:α1-MG除去とアルブミン(Alb)漏出の“許容レンジ”のバランス+置換液量(濾過量)の最適化。
- 評価:症状・QOLとともにα1-MG指標、TMP推移、Albをフォロー。
目次
オンラインHDFの定義と仕組み
HDF=拡散+濾過/オンラインとオフラインの違い(EUDIALの定義要点)
EUDIAL 2013はHDFを「高透水性膜を用い、拡散と濾過で溶質を除去し、十分な置換液量(濾過量)を達成する透析」と定義。オンラインHDFは透析液を患者へ直接注入する点が、オフラインと異なります。
参考文献:Tattersall JE, NDT 2013(EUDIAL定義)/PubMed
前希釈・後希釈・I-HDFの違い(図予定)
- 前希釈:血液をフィルタに入る前に希釈。大量置換しやすい(日本の主流)。
- 後希釈:フィルタ通過後に補充。同じ置換液量(同じ濾過量)では中分子除去効率が高いが、QB依存・Albリーク管理の難度が上がる。
- I-HDF:間欠的に補液・逆濾過を交互に行い、循環動態の安定や膜洗浄をねらう。
参考文献:土田 健司「大量濾過オンラインHDFの有用性」臨牀透析 33巻5号(2017)/伊丹ほか「海外のオンラインHDFの現状と課題」臨牀透析 33巻5号(2017)/臨牀透析 39巻5号(2023)オンラインHDF特集(TMP監視・Alb漏出管理 等)
日本で主流の「前希釈」—なぜ選ばれるのか(α1-MG志向の背景)
日本はQBが中等度(例:250–300 mL/分)で、前希釈×高性能膜によりα1-MG(33000Da)など“大きめの中分子”まで狙う透析が普及しています。
JRDR 2021年報でもHDF比率の高さが示されています。
参考文献:RRT(JRDR 2021年報の英語版要約)/JSDT年報 2021(J-STAGE)
目的と適応(誰に・何のために)
ターゲット溶質:β2-MG/α1-MG/蛋白結合毒素
HDFは、小分子(尿素)中心のHDでは不足しがちな中〜大分子(例:β2-MG)や、α1-MG、一部の蛋白結合毒素の除去効率を高める狙いが中心です。α1-MG指標の妥当性では、α1-MGの十分な除去にはAlb漏出がある程度不可避とされています。
参考文献:Sakurai K, RRT 2021/Armenta-Alvarez A, 2023(Albumin loss & middle molecules)
症状改善の狙い:瘙痒・RLS・関節痛・倦怠感
臨床的には皮膚瘙痒、むずむず脚症候群(RLS)、骨・関節痛、倦怠感の軽減を期待。中分子負荷の低減が機序の一つと考えられています。
参考文献:Hung Y-H, 2022(系統的レビュー)/臨牀透析 33巻5号(2017)特集総説
HD→HDF切替の典型シナリオ
- HDで症状残存(瘙痒・RLS・関節痛・透析中低血圧など)。
- β2-MGは十分でも、α1-MG高値が持続。
- 予後の改善が期待できる症例(年齢・併存症・栄養状態を併せて総合判断)。
参考文献:土田 健司「大量濾過オンラインHDFの有用性」臨牀透析 33巻5号(2017)/伊丹ほか「海外のオンラインHDFの現状と課題」臨牀透析 33巻5号(2017)
| 方式 | 狙いどころ | 置換液量の目安 | 補足 |
|---|---|---|---|
| 前希釈 (日本の主流) |
α1-MGなど“大きめの中分子” | 40–60 L/回(4h想定) | 平均は約40 L。24–72 Lの範囲報告。大量置換しやすい。 |
| 後希釈 | 同量でも中分子除去効率が高い | 15–25 L/回 | 高用量群で死亡率低下を示す研究がある(試験間で差あり)。 |
参考:EUDIAL定義/JRDR・総説/RCT(ESHOL, CONVINCE 等)
置換液量→QS(mL/min)かんたん換算
必要なQS:208 mL/min
例)50 L/240分→約208 mL/min(前希釈の初期設定の目安に)。
効果のエビデンスと限界
透析中低血圧・QoL・炎症指標:一致点/不一致点
低血圧抑制やQOL改善を示す報告があります。
参考文献:臨牀透析 39巻5号(2023)オンラインHDF特集(TMP監視・Alb漏出管理/運転条件の工夫)
研究デザインの違い(希釈法・QB・膜)と外挿の注意
欧州:後希釈×高QB(300–400)、日本:前希釈×中QB(250–300)で前提が異なります。膜(材質/面積/分画特性)も統一ではありません。
参考文献:土田 健司「大量濾過オンラインHDFの有用性」臨牀透析 33巻5号(2017)/臨牀透析 39巻5号(2023)オンラインHDF特集
処方設計の基本(はじめの一歩)
目標設定:α1-MG除去率/Alb漏出“許容レンジ”/置換液量(濾過量)
- α1-MG:除去率と除去量のいずれでも評価可。十分な除去にはAlb漏出の容認が前提(過度はNG)。
- Alb漏出:栄養状態をみて許容レンジを決める
- 置換液量(濾過量):体格・モードに応じて設定(例:前希釈では総置換40–60 L/回を出発点に、TMPやAlbを見ながら微調整)。
参考文献:Sakurai K, RRT 2021(α1-MGとAlbの関係)/Okada K, RRT 2022(EALと転帰)/臨牀透析 39巻5号(2023)オンラインHDF特集
運転条件:QB・QS/TMP監視(定圧vs定速)/ファウリング対策
- QB/QS:前希釈はQB 250–300、QSは膜・回路差圧を見ながら段階的に上げる。
- TMP監視:Alb漏出はTMP上昇と相関。定圧制御(TMPフィードバック)はリーク安定化に有利だが、総置換の自動変動に留意。
- ファウリング:圧モニタで早期検知、I-HDFの逆濾過や運転プロファイルで洗浄。
参考文献:Pedrini LA, KI 2006(TMPフィードバック)/臨牀透析 39巻5号(2023)オンラインHDF特集(TMP監視・運転条件)
膜選択:分画特性とアルブミンリーク(例:MFX系の型・面積の使い分け)
膜の分画はβ2-MG〜α1-MG域で差が出ます。Albリークが少ない膜は安全だがα1-MG除去が頭打ちになりやすく、逆にAlbリーク型では除去を伸ばしやすい一方で栄養管理が必須です。
参考文献:van Gelder MK, NDT 2018(アルブミン取り扱いレビュー)/臨牀透析 33巻5号(2017)特集総説
電解質の注意点
Caバランスと透析液Ca:2.5/2.6/2.75 mEq/Lの使い分け
- 基本:国際的には2.5 mEq/Lが標準(個別調整あり)。
- 実務の調整:日本では2.6 mEq/Lの選択肢が広がり、3.0→2.6 mEq/Lへの切替でCa負荷低減・Mg上昇(保護)を示す報告あり。
- 2.75 mEq/L:2.5/3.0の中庸として、循環動態や心機能面でバランスが取れる可能性の報告。
参考文献:KDOQI Bone(D-Ca 2.5推奨)/Yamada S, RRT 2024(3.0→2.6とMg 1.2)/Sakoh T, 2019(2.75 mEq/Lの長期効果)
内部リンク:カルシウム単位換算(実務ツール)
K・Na・浸透圧:低血圧予防と除水設計の整合
- K:急速低下は不整脈リスク。
- Na・浸透圧:低Na・急速除水は低血圧を招きやすい。
参考文献:KDOQI HD Adequacy 2015/臨牀透析 39巻5号(2023)オンラインHDF特集(循環動態・Na設計の工夫)
よくある質問(FAQ)
Q. 「置換液量(濾過量)が多いほど、必ず良い?」
A. 生存率の改善を示す結果(CONVINCE、ESHOL)はある一方、CONTRASTのように差が出ない試験も。
参考文献:前掲各試験/伊丹ほか「海外のオンラインHDFの現状と課題」臨牀透析 33巻5号(2017)
まとめ(3行で要点)
- HDFは中〜大分子を狙う透析。日本では前希釈×高性能膜が主流。
- α1-MGとAlb漏出のバランス+置換液量(濾過量)最適化が設計の肝。
- 効果は症状・指標・TMP・Albで定期評価し、過大/過小除去を回避。
